由于缺乏检测临床前期生物标志物的工具,包括帕金森综合征(PD)和阿尔茨海默症在内的神经退行性疾病(NDD)的诊断颇具挑战性。蛋白质错误折叠成寡聚体和纤维状聚集体在NDD的发生和进展中起着重要作用,因此基于结构生物标志物诊断的必要性尤为凸显。红外(IR)光谱被认为是一种很有前途的NDD诊断方法,这是由于该方法可以通过无标记且非侵入性的方式提供化学特异性和结构敏感检测。表面增强红外吸收(SEIRA)光谱学是一种新兴的检测方法,可扩大红外光谱的生物传感能力。
据麦姆斯咨询报道,近日,瑞士洛桑联邦理工学院(EPFL)的科研团队在Science Advances期刊发表了以“Artificial intelligence–coupled plasmonic infrared sensor for detection of structural protein biomarkers in neurodegenerative diseases”为主题的论文。该论文的第一作者为Deepthy Kavungal,通讯作者为Hilal A. Lashuel和Hatice Altug。
这项研究报道了一种免疫分析耦合的纳米等离子体红外超构表面(metasurface)传感器,可以特异性地检测与NDD相关的蛋白质,如α-突触核蛋白(aSyn),并利用其独特的吸收特征区分不同的蛋白质结构种类。研究人员利用人工神经网络增强了该传感器,使其能够定量预测其混合物中的寡聚体和纤维状聚集体。而微流控集成传感器可以在复杂生物基质存在的情况下检测时间分辨的吸光度“指纹”,并且能够多路复用以便同时监测多种病理相关的生物标志物。因此,这项研究开发的红外超构表面传感器有望成为NDD临床诊断、疾病监测以及新疗法评估的一种有前途的选择。
光流控等离子体SEIRA的实现,用作结构生物标志物传感器
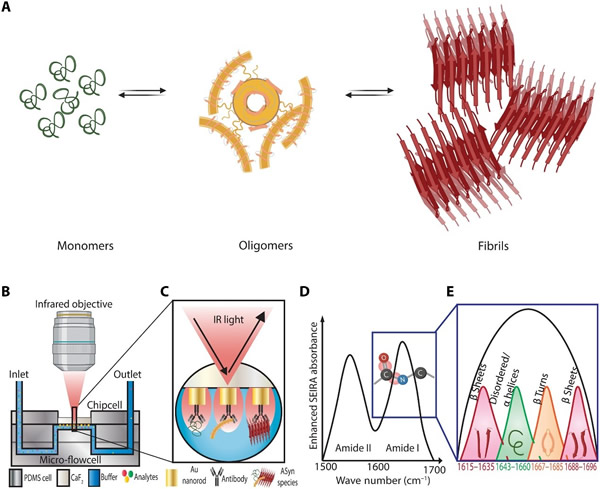
图1A显示了不同结构的aSyn物种,如存在于路易体(Lewy body)形成途径上的单体、寡聚体和原纤维。图1B至图1E概述了该研究的测量设置以及等离子体SEIRA作为结构生物标志物传感器的检测原理。光流控传感器由放置在含有微流控通道的聚二甲基硅氧烷(PDMS)部件中的等离子体芯片构成。在等离子体内反射(PIR)配置下,从芯片背面收集红外光照和反射信号,以提取蛋白质二级结构特征,尽管与水性缓冲液吸光度存在重叠(如图1B)。研究人员将SEIRA与免疫分析法(ImmunoSEIRA)相结合,选择性地捕获aSyn物种进行基于结构的区分(如图1C)。
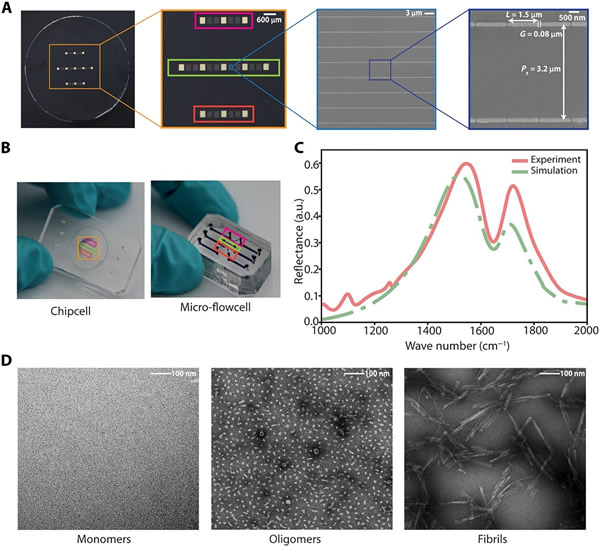
研究人员在红外透明氟化钙(CaF2)衬底上制备了纳米等离子体微阵列芯片,其微阵列由三平行组成,其中每行分别包含线性排列的超构表面元件以及用于传感和定位的金质反射镜(如图2A)。随后,将传感器芯片放置于PDMS部件中(即芯片单元,如图2B左所示)。当与芯片单元结合时,这些独立通道的位置与其对准,三个通道与传感元件和反射镜的三行对应重叠。
用于aSyn物种捕获和光谱分析的ImmunoSEIRA
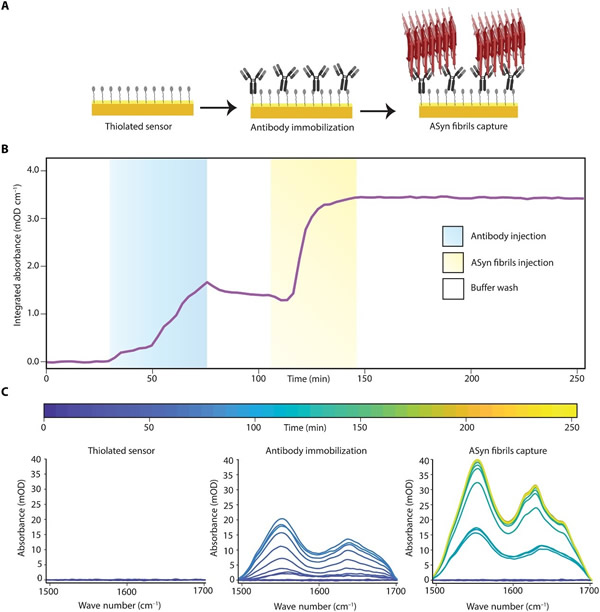
该传感器的光谱特异性为基于结构生物标志物的诊断方法提供了固有优势。但在体液中含有大量生物分子的临床环境中,靶点选择性就变得至关重要。因此,研究人员利用SEIRA传感器结合了免疫分析与光谱学的优势,使用表征和验证良好的aSyn特异性抗体来捕获aSyn物种。免疫分析的工作流程为简单的三步程序,如图3A所示。
构象分析区分aSyn的不同结构种类
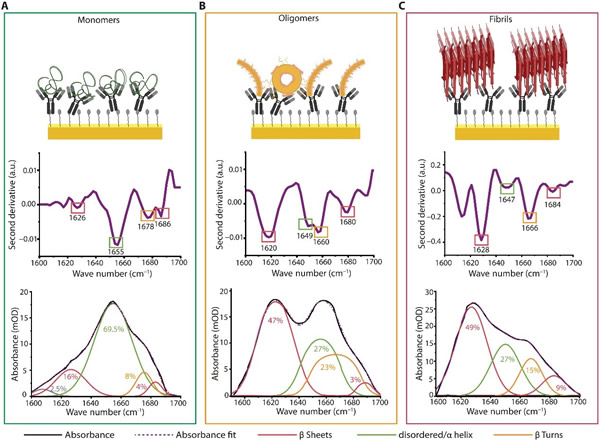
接下来,研究人员试图研究该传感器识别三种aSyn(即单体、寡聚体和原纤维)的二级结构的能力,通过对其酰胺I波段深入分析以进行构象分析。图4展示了对aSyn单体(i)、寡聚体(ii)和原纤维(iii)的完整分析。值得注意的是,研究人员成功地破译了寡聚体种类的结构成分(如图4B),这为在基于免疫分析的诊断工具中使用基于aSyn物种特异性结构的生物标志物铺平了道路。
AI辅助的ImmunoSEIRA传感
在患者样本中,这三种aSyn很可能同时以不同水平存在。因此,亟待开发能够准确定量每种结构的aSyn(包括寡聚体和原纤维)的新方法。为了确定人工智能(AI)与ImmunoSEIRA相结合的方法能否区分寡聚体和原纤维,研究人员在这里提出了一种测定疾病不同阶段样本中总聚集物存在情况的合理方案,开始时主要是寡聚体,但原纤维逐渐增加,并最终成为混合物中的优势物种(如图5A)。
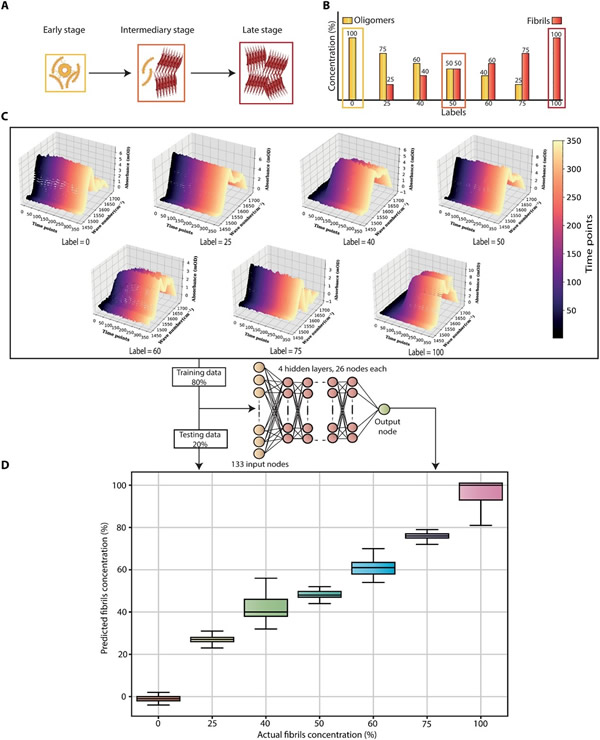
值得注意的是,在该DNN分析中,研究人员使用了包括吸收信号微弱及有噪声的初始时间点在内的原始光谱数据。尽管信号水平较低,在未进行滤波和平均的情况下,该AI辅助的ImmunoSEIRA传感器表现稳定且对结构敏感。这项性能至关重要,能够为检测和量化aSyn寡聚体和原纤维铺平道路,并且在预期生理浓度较低的纵向研究中,可在疾病进展过程中关联其比率。因此,提出的新方法能够更准确地了解蛋白质聚集体在疾病中的作用以及其诊断价值,并且在无需任何人工滤波和其他步骤的情况下,可利用单个样本进行定量研究。
作为概念验证,研究人员在检测来自单个样本的两种不同结构的生物标志物蛋白(aSyn和tau)的同时,评估了扩展和复用该ImmunoSEIRA微阵列传感器的潜力。研究结果如图6和图7所示。
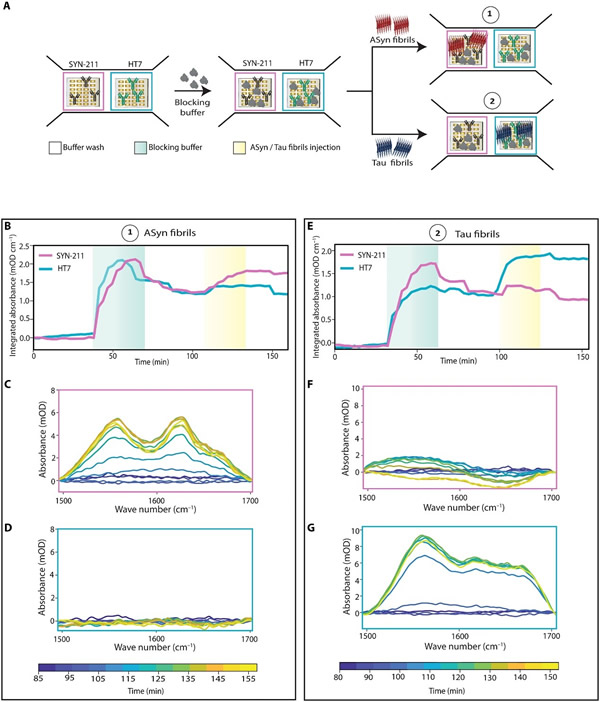
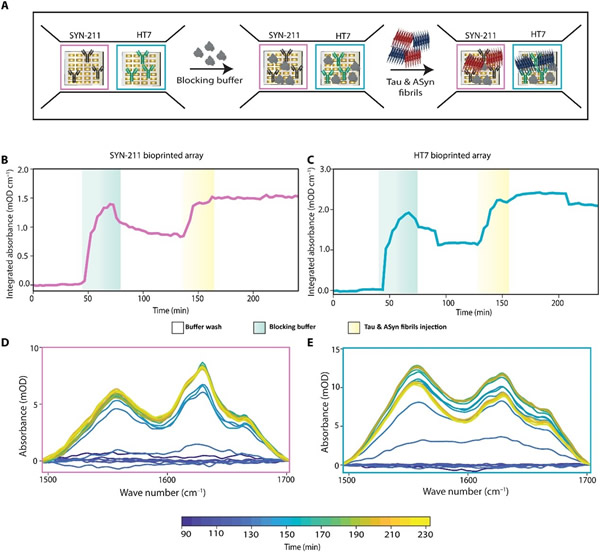
为使这项研究所开发的传感器更接近临床应用,评估其在复杂生物基质中的检测能力非常重要。为了证明该传感器的可行性,研究人员使用了通过内部优化方案耗尽aSyn的健康人类脑脊液(CSF)样本作为生物基质。研究人员观察发现,牛奶缓冲液是一种合适的阻断剂,它可以最大限度地减少生物基质中分子或蛋白质的非特异性结合。实验过程如图8A所示。
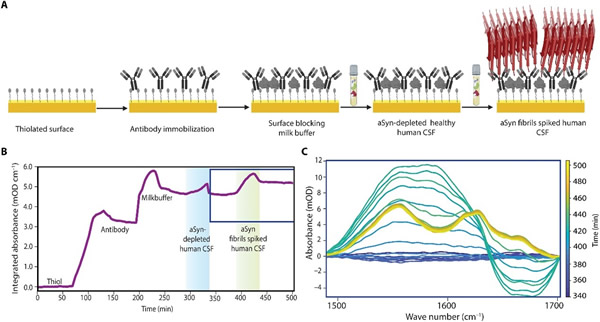
综上所述,这项研究通过对蛋白质生物标志物的结构分析,探索了SEIRA作为诊断工具的独特能力。展望未来,研究人员预计,使用血清或血浆等非侵入性且易于获取的样本取代脑脊液等侵入性生物液体有望提高新型生物传感器在PD和NDD诊断中的适应性。此外,ImmunoSEIRA传感器的优化有助于实现与患者样本中蛋白质生物标志物水平相关的所需检测极限。该二维微阵列等离子体芯片与微流控的兼容性有望为未来研究中提高分析通量带来优势。将该传感器的制备方法转换为晶圆级方法有望进一步缩短制备时间并降低单个芯片的成本,从而促使SEIRA衬底在未来以较低的价格实现商业化。从技术角度来看,利用量子级联激光器、量子级联探测器以及平面超构光学(meta-optics)等新兴红外技术,从体积庞大的傅立叶变换红外(FTIR)测量工具转向高度紧凑型片上中红外生物传感器是另一项开放性挑战。但这也为将新开发的红外传感器应用于生物、医学以及制药研究与临床应用开辟了新机遇。
这项研究获得了欧洲研究理事会(VIBRANT-BIO,682167)、欧盟“地平线2020”科研与创新架构计划(NOCTURNO,777714)、专注于帕金森研究的Michael J. Fox基金会以及洛桑联邦理工学院的资助和支持。
论文信息:
DOI: 10.1126/sciadv.adg9644

